PDZドメイン(英: PDZ domain)は、細菌、酵母、植物、動物、ウイルスのシグナル伝達タンパク質に存在する、80–90アミノ酸からなる構造ドメインである。PDZドメインを持つタンパク質は、膜中の受容体タンパク質を細胞骨格の構成要素へ固定する際に重要な役割を果たしている。こうしたドメインを持つタンパク質はシグナル伝達複合体の細胞膜での保持と組織化を補助しており、このドメインはシグナル伝達複合体の形成と機能に重要な役割を果たしている。PDZドメインは細胞表面受容体(CFTRやFZD7など)を、NHERFやエズリンなどの因子を介してアクチン骨格へ固定する際に極めて重要な役割を果たしている。
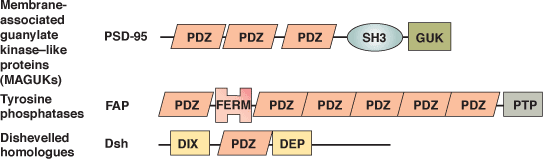
「PDZ」は、このドメインを持つことが最初に発見された3つのタンパク質、PSD95、DLG1、ZO-1の頭文字を組み合わせたものである。PDZドメインは以前にはDHR(Dlg homologous region)ドメインやGLGF(glycine-leucine-glycine-phenylalanine)ドメインといった名称でも呼ばれていた。
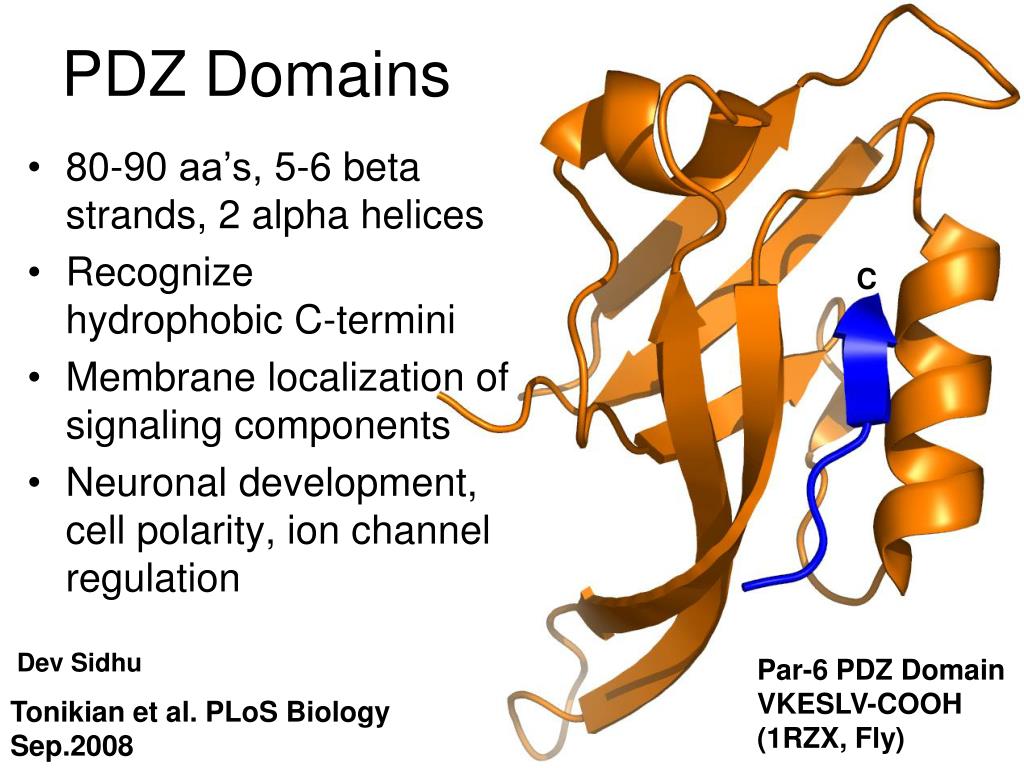
一般的に、PDZドメインは特異的タンパク質のC末端の短い領域に結合する。こうした短い領域はPDZドメインに対してβ-sheet augmentation機構によって結合する。すなわち、PDZドメインのβシートに結合パートナータンパク質のテール由来のβストランドが付加されてβシート領域が広がることで結合は行われる。C末端のカルボキシル基にはPDZドメインのnestが結合する。
発見
「PDZ」は、このドメインが最初に発見されたタンパク質の頭文字に由来する。PSD-95(post-synaptic density protein 95)は、脳にのみ存在するシナプスタンパク質である。Dlg1(disc large homolog 1)とZO-1(zona occludens 1)はどちらも細胞結合部のシグナル伝達複合体中で重要な役割を果たす。PDZドメインの発見以降、数百種類のPDZドメインが同定されている。「PDZドメイン」というフレーズが最初に出版物で使用されたのは論文においてではなく、レターにおいてである。1995年9月、カリフォルニア工科大学のMary B. KennedyはTrends in Biomedical Sciences誌に訂正のためのレターを書いた。その年には、他の科学者たちがDHRドメインという名称の新たなタンパク質ドメインを発見したと主張していた。Kennedyは、それが以前に自身の研究室によって“GLGF repeats”として記載されていたものと全く同じドメインであると反論した。彼女はドメインの起源と分布についてよりよく反映させた、新たなドメインの名称へと変更するつもりであると説明を続けた。こうして「PDZドメイン」という名称が生まれた。
構造
PDZドメインの構造は、このドメインを持つさまざまなタンパク質の間で部分的に保存されており、通常5–6本のβストランドと長短1本ずつのαヘリックスを持つ。この保存されたフォールドの以外の二次構造はPDZドメイン間で異なる。このドメインは直径約35 Åの球状構造をとる傾向がある。
PDZドメインは通常は単量体として単離されるが、PDZタンパク質のいくつかは二量体を形成する。こうしたPDZ二量体が単量体と比較してどのような機能を持つのかに関しては未解明である。
PDZドメインの結合ポケットに関して一般に受容されているモデルでは、ポケットは上述のGLGF配列に加えていくつかの疎水性アミノ酸によって構成されており、その主鎖の原子はタンパク質またはペプチドリガンドのC末端のカルボキシル基を結合するnestを形成している。大部分のPDZドメインでは、こうした結合部位はβストランドの1本と長いαヘリックスとの間に位置している。
機能
PDZドメインには、細胞要素の局在、細胞経路の調節という2つの主要な機能が存在する。
最初に発見されたPDZドメインの機能は、膜中の受容体タンパク質を細胞骨格の構成要素へ固定することである。また、PDZドメインはさまざまなシグナル伝達経路を調節する機能も持つ。PDZドメインは各タンパク質に1つだけ存在する場合も複数存在する場合もあり、また各ドメインは同一のものであったりそれぞれ独特で異なるものであったりする。こうした多様性は、PDZドメインを持つタンパク質の相互作用を非常に多彩なものにしている。同じタンパク質内に存在するPDZドメインがそれぞれ異なる役割を持っている場合があり、各ドメインが標的タンパク質の異なる部分に結合したり、完全に異なるタンパク質に結合したりする。
局在
PDZドメインは複雑な足場構造の形成や維持に重要な役割を果たしている。
PDZドメインは多様なタンパク質に存在し、細胞の要素の局在を補助している。PDZドメインは主に受容体タンパク質の細胞骨格への固定に関与している。細胞が適切に機能するためには、その構成要素(タンパク質やその他の分子)が適切な時期に適切な場所にあることが重要である。PDZドメインを持つタンパク質はさまざまな構成要素に結合し、適切な配置を保証している。神経細胞において神経伝達物質の活動が意味を成すためには、特異的受容体がシナプスの脂質膜中に位置していなければならない。PDZドメインはこうした受容体の局在過程に重要である。PDZドメインを持つタンパク質は一般的に、受容体のC末端と細胞骨格要素の双方に結合し、受容体を細胞骨格に係留して適切な場所に維持している。こうした相互作用がなければ、脂質膜の流動性のために受容体はシナプスから拡散してしまこととなる。
PDZドメインは受容体タンパク質以外の要素の局在にも利用される。ヒトの脳では、一酸化窒素はシナプスでのNMDA受容体の活性化に応答してcGMP濃度を変化させる作用を果たすことが多い。PSD-95は神経型一酸化窒素合成酵素(nNOS)とNMDA受容体に同時に結合する。nNOSがPSD-95のPDZドメインとの相互作用を介してNMDA受容体に近接することで、望ましい空間的配置が保証されている。nNOSはNMDA受容体に近接して位置することで、細胞内へのカルシウムの流入の直後に活性化が行われる。
調節
PDZドメインはさまざまな細胞経路の調節に直接関与している。PDZドメインはさまざまな細胞構成要素と相互作用することができるため、調節の機構は多様である。こうした調節は、上述のnNOSとNMDA受容体の例のように、複数のシグナル伝達分子の共局在によるものであるのが常である。ホスファターゼ酵素の活性、機械受容シグナルの伝達、エンドサイトーシスされた受容体タンパク質の選別経路といった経路の調節がPDZドメインによって行われる。
ヒトのチロシンホスファターゼPTPN4のシグナル伝達はPDZドメインによって調節される。このタンパク質は細胞死の調節に関与している。通常、この酵素のPDZドメインは非結合状態である。酵素はこの非結合状態で活性があり、アポトーシスのための細胞シグナル伝達を防いでいる。このホスファターゼのPDZドメインが結合することで、酵素は活性を失い、アポトーシスが引き起こされる。この酵素の正常な調節は細胞が尚早にアポトーシスを起こすことを防いでいる。PTPN4の調節が失われると、細胞は増殖できるようになって発がん性が増加する。
PDZドメインは、固有受容器や前庭系や聴覚系の有毛細胞における機械受容シグナル伝達を調節する役割も持つ。Whirin(WHRN)タンパク質は、機械的運動を活動電位に変換する有毛細胞のシナプス後ニューロンに局在する。WHRNタンパク質には3つのPDZドメインを持つ。N末端近傍に位置するドメインは、受容体タンパク質とその他のシグナル伝達要素に結合する。これらのPDZドメインのいずれか1つが阻害された場合には、ニューロンのシグナル伝達経路は破壊され、聴覚、視覚、前庭系に異常が生じる。この調節は、WHRNの物理的な配置とそのPDZドメインの選択性に基づいて行われていると考えられている。
受容体タンパク質の調節は、EBP50タンパク質のPDZドメインのβ2アドレナリン受容体(β2-AR)のC末端への結合でみられる。EBP50はアクチンへの連結を行う複合体とも結合し、細胞骨格とβ2-ARとの連結を作り出す。β2-ARは最終的にはエンドサイトーシスされ、分解のためにリソソームへ送られるか、もしくは再び細胞膜へ送り返される。β2-ARのPDZ結合ドメインのSer411残基がリン酸化されている場合には、受容体が分解されることが明らかにされている。Ser411が未修飾の場合には受容体はリサイクルされる。こうしたPDZドメインとその結合部位が果たす役割は、単なる受容体タンパク質の局在だけでなく調節における重要性を示している。
PDZドメインがさまざまなシグナル伝達経路で果たす役割をより良く理解するため、さらなる研究が行われている。また、これらのドメインは上述したようにがんなどさまざまな疾患と関連していることから、より多くの研究が行われるようになっている。
PDZドメインの活性の調節
PDZドメインの機能はさまざまな機構によって阻害や活性化が行われる。最も広くみられる機構は、アロステリック相互作用と翻訳後修飾である。
翻訳後修飾
PDZドメインに最も一般的にみられる翻訳後修飾はリン酸化である。この修飾は主にPDZドメインやリガンドの活性を阻害する役割を果たす。側鎖のリン酸化はPDZドメインの水素結合形成能力が消失させ、正常な結合パターンが破壊される。その結果、PDZドメインの機能やその後のシグナル伝達が失われる。リン酸化がPDZドメインの正常な機能の破壊は、荷電比の変化によって結合やシグナル伝達に影響を及ぼすことで行われることもある。稀なケースでは、翻訳後修飾によってPDZドメインが活性化される場合もある。
PDZドメインを調節する他の翻訳後修飾には、ジスルフィド結合の形成がある。多くのPDZドメインにはシステインが含まれ、酸化条件下におけるジスルフィド結合形成に対して感受性である。この修飾は主にPDZドメインの機能の阻害因子として作用する。
アロステリック相互作用
タンパク質間相互作用がPDZドメインのリガンドへの結合効果を変化させることが観察されている。特定のタンパク質では、アロステリック効果によって異なる基質に対する結合親和性が変化する場合がある。異なるPDZドメインが互いにこのアロステリック効果を利用しあう場合さえもある。こうしたPDZ-PDZ間相互作用は阻害因子としてのみ作用する。エズリンの結合はPDZタンパク質NHERF1の結合活性を亢進させることが発見されている。
PDZタンパク質
PDZドメインを持つタンパク質はPDZタンパク質と呼ばれる。PDZドメインは既知の数千種類のタンパク質に存在する。PDZタンパク質は真核生物と真正細菌では広くみられるが、古細菌タンパク質にはきわめてわずかな例しか存在しない。PDZドメインは多くの場合他のタンパク質ドメインと関係しており、こうした組み合わせによって特異的機能が発揮される。PDZタンパク質として最もよく記載されている3つのタンパク質として、ここではPSD-95、GRIP、HOMERを取り上げる。
PSD-95は脳のシナプスタンパク質で、3つのPDZドメインを持つ。そのそれぞれが独特な性質と構造を持ち、PSD-95の多様な機能を可能にしている。一般的に、最初の2つのPDZドメインは受容体と相互作用し、3番目のものは細胞骨格関連タンパク質と相互作用する。PSD-95が結合する主な受容体はNMDA受容体である。PSD-95の最初の2つのPDZドメインはNMDA受容体のC末端に結合し、受容体を神経伝達物質放出部位の膜に固定する。最初の2つのPDZドメインはShaker型カリウムチャネルとも同様に相互作用する。PSD-95とnNOS、シントロフィンとの結合は2番目のPDZドメインを介して行われる。3番目のPDZドメインはCRIPTと結合し、PSD-95と細胞骨格との結合を可能にする。
GRIPは、PSD-95とNMDA受容体との間の相互作用と類似した形で、AMPA受容体との相互作用を行うシナプス後タンパク質である。AMPA受容体とNMDA受容体のC末端の構造的相同性が発見された際、NMDA受容体と同様にAMPA受容体とPDZを介した相互作用を行うタンパク質の探索が行われた。酵母ツーハイブリッド法からGRIPの7つのPDZドメインの発見が導かれ、そのうちの2つ(ドメイン4、5)がGluR2と呼ばれるAMPAサブユニットへのGRIPの結合に必須であることが明らかにされた。この相互作用は、記憶の保管に大きな役割を果たしているAMPA受容体を適切に局在させるために重要である。また、GRIPのドメイン6と7はEph受容体と呼ばれる受容体型チロシンキナーゼファミリーとGRIPとの連結を担っていることが発見された。これらの受容体は重要なシグナル伝達タンパク質である。臨床研究によって、フレイザー症候群と呼ばれる重度の奇形を伴う常染色体劣性症候群は、GRIPの変異によって引きこされる場合があることが結論付けられている。
HOMERは、GRIPやPSD-95などの既知の多くのPDZタンパク質とは大きく異なる。GRIPやPSD-95などのようにイオンチャネルとの相互作用を媒介するのではなく、HOMERは代謝型グルタミン酸受容体シグナル伝達に関与している。HOMERの独特な他の点は、PDZドメインを1つしか持たないという点である。このドメインはHOMERとmGluR5との相互作用を媒介している。HOMERに唯一存在するGLGFリピートはmGluR5のC末端のアミノ酸に結合する。HOMERはラットの胚発生時に高レベルで発現していることから、発生に重要な機能を持っていることが示唆される。
出典
関連文献
外部リンク
- The PDZ Domain as a Complex Adaptive System - 複雑適応系としてのPDZドメインについての簡潔な技術的要約と主要な知見や影響に関する報告書
- NCBI conserved domains entry
- https://www.pdznet.eu - がんや神経疾患といった健康状態や病態における、PDZドメイン含有タンパク質を介した細胞内シグナル伝達経路や治療可能性についての理解を深めるためのEUプロジェクト