O-GlcNAc転移酵素(O-GlcNAcトランスフェラーゼ、英: O-GlcNAc transferase、OGT)は、ヒトではOGT遺伝子にコードされる酵素(EC 2.4.1.255)である。OGTはタンパク質に対するO-GlcNAc化翻訳後修飾を触媒する。
シノニム
他の名称としては次のようなものがある。
- Protein O-GlcNAc transferase
- OGTase
- O-linked N-acetylglucosaminyltransferase
- Uridine diphospho-N-acetylglucosamine:polypeptide β-N-acetylglucosaminyltransferase
系統名: UDP-N-α-acetyl-d-glucosamine:[protein]-3-O-N-acetyl-β-d-glucosaminyl transferase
機能
グリコシルトランスフェラーゼ
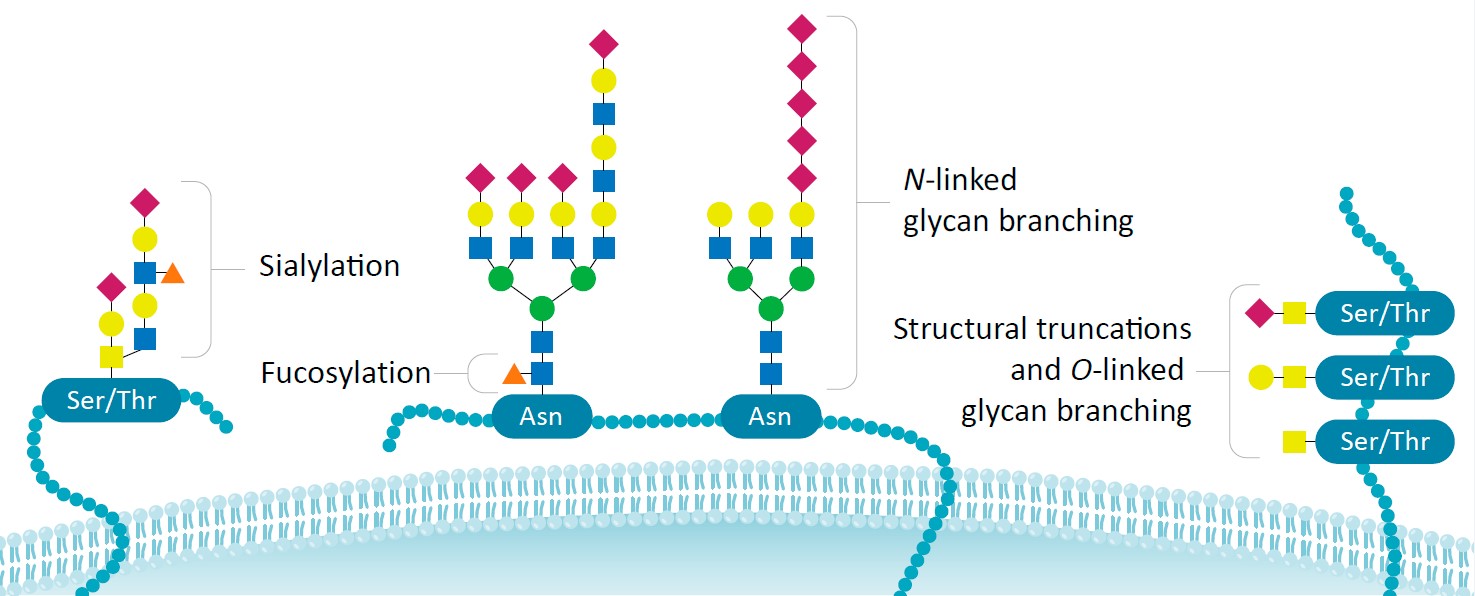
OGTは、核や細胞質のタンパク質のセリンまたはスレオニン残基に対してO-グリコシド結合、そしてシステイン残基に対してS-グリコシド結合によってN-アセチルグルコサミン(GlcNAc)を1つ付加する反応を触媒する。リン酸化とO-GlcNAc化はともにセリンまたはスレオニン残基に対して作用するため、2つの過程は修飾部位をめぐって競合したり、または立体障害や静電的効果によって近接する部位の基質特異性を変化させたりする可能性がある。OGT遺伝子には、細胞質型とミトコンドリア型のアイソフォームをコードする2種類の転写産物バリアントが知られている。OGTは、ヒストンH2B、AKT1、PFKL、KMT2E/MLL5、MAPT/TAU、HCFC1、SIN3Aなど多くのタンパク質をグリコシル化することが知られている。
OGTは体内の多くの生物学的機能に関与している。OGTは筋細胞や脂肪細胞のインスリン抵抗性に関与しており、AKT1のT308のリン酸化を阻害し、IRS1のS307やS632/635のリン酸化率を高め、インスリンシグナルを減少させ、インスリンシグナル伝達の構成要素をグリコシル化する。OGTは胚発生にも重要であり、胚性幹細胞の生存にはOGTが必要である。OGTは転写因子やRNAポリメラーゼIIも修飾するが、その特異的機能は大部分が不明である。
タンパク質の切断の誘導
OGTのHCFC1への結合は、HCFC1の切断を誘導する。HCFC1の切断にはOGTとの相互作用が必要であり、OGTの核内での安定化にはHCFC1が必要である。OGTはHCFC1との相互作用とO-GlcNAc化を介して切断を調節しているが、相互作用の正確な機構は不明である。
構造
ヒトのOGTは1046アミノ酸残基から構成され、当初は三量体を形成すると考えられていたが、その後の解析では二量体であることが支持されている。約110 kDaのサブユニットには13個のテトラトリコペプチドリピート(TPR)が含まれ、13番目のリピートは切り詰められている。サブユニットは6番目と7番目のリピートを介して二量体化する。OGTは膵臓で高度に発現しており、心臓、脳、骨格筋、胎盤でも発現している。肺や肝臓にも微量存在する。活性部位は508番残基と推定されている。
OGTの結晶構造に関しては、UDPとの二者複合体、そしてUDP、ペプチド基質との三者複合体構造が明らかにされている。OGTの触媒領域には、N末端ドメイン(N-Cat)、C末端ドメイン(C-Cat)、そしてintervening domain(Int-D)という3つのドメインが含まれている。触媒領域とTPRはtransitional helix(H3)によって連結されており、 このヘリックスは触媒領域の上面に沿ってC-CatからN-Catへらせんを形成している。2021年には、cryo-EMによる5 Å分解能での解析により触媒領域と完全なTPR領域との関係が明らかにされ、二量体の配置が確認された。これらの構造は触媒反応が定序逐次Bi-Bi機構によって生じることを支持しており、基質ペプチド飽和条件下でのUDPによるUDP-GlcNAcに対する競合阻害パターンと一致する。
触媒機構
OGTによる触媒の分子機構として提唱されている機構は、UDP-GlcNAcが結合し、そして反応性のセリンまたはスレオニン残基を有するペプチド鎖が結合することで反応が進行するという定序逐次Bi-Bi機構であり、ペプチド飽和条件でのUDPによる阻害パターンからもこの機構が支持される。
化学反応は次のように表される。
- UDP-N-acetyl-D-glucosamine [protein]-L-serine → UDP [protein]-3-O-(N-acetyl-D-glucosaminyl)-L-serine
- UDP-N-acetyl-D-glucosamine [protein]-L-threonine → UDP [protein]-3-O-(N-acetyl-D-glucosaminyl)-L-threonine
まず、セリンのヒドロキシル基は触媒塩基であるヒスチジン498番によって脱プロトン化される。リジン842番もUDP部分を安定介する役割を果たす。その後、脱プロトン化された酸素原子がグルコサミンとUDPの間の糖-リン酸結合を攻撃する。その結果、UDP-GlcNAcはGlcNAc-ペプチドとUDPへ開裂する。そして、リン酸基とヒスチジン498番でプロトン転移が生じる。
阻害剤
OGTの酵素活性の阻害剤は多く報告されている。OGTの阻害はO-GlcNAcの全般的ダウンレギュレーションを引き起こす。細胞はOGTの阻害に応答して、OGTのアップレギュレーションとO-GlcNAcアーゼ(OGA)のダウンレギュレーションを引き起こすようである。
5S-GlcNAc
Ac45S-GlcNAcは、細胞内でOGTの基質アナログ阻害剤であるUDP-5S-GlcNAcへ変換される。UDP-5S-GlcNAcはピラノース環の酸素が硫黄で置換されているため、OGTはUDP-5S-GlcNAcを糖供与体として効率的に利用することはできない。他のグリコシルトランスフェラーゼもUDP-GlcNAcを糖供与体として利用するため、UDP-5S-GlcNAcは細胞表面のグリコシル化にも一部、非特異的影響を及ぼす。
OSMI
OSMI-1は蛍光偏光を用いたハイスループットスクリーニングによって同定された阻害剤である。その後の最適化によりOSMI-2、OSMI-3、OSMI-4が開発され、これらは低nMの親和性でOGTに結合する。X線結晶構造解析により、OSMI化合物のキノリノン-6-スルホンアミド骨格がウリジンを模倣していることが示されている。OSMI-2、OSMI-3、OSMI-4は負に帯電したカルボキシル基を持ち、エステル化によって細胞透過性となる。
調節
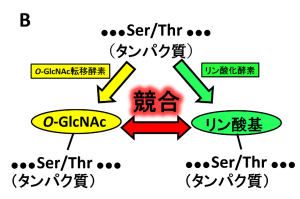
OGTによるO-GlcNAc化とプロテインキナーゼによるリン酸化は、セリンまたはスレオニンのヒドロキシル基をめぐって動的に競合する。両者が同一の部位に対して作用する場合、OGTはグリコシル化を行うことでキナーゼによるリン酸化に競合する。また近接した部位に対して作用する場合には両者が相互に影響を及ぼすことがあり、OGTによるp53のO-GlcNAc化はリン酸化を低下させ、p53を分解から保護する。
タンパク質のO-GlcNAc修飾は、ヘキソサミン生合成経路を介したグルコースフラックスによって駆動される。OGTはセリンやスレオニン残基へのO-GlcNAc基の付加を触媒し、一方OGAは糖の除去を触媒する。こうしたOGTとOGAによる調節は、転写、シグナル伝達、プロテアソーム分解など複数の細胞過程に重要である。また、OGTとプロテインキナーゼの間にはリン酸基を付加するかGlcNAcを付加するかの競合的調節が存在し、その結果タンパク質の機能が変化する場合がある。OGTはO-GlcNAc化を通じてPFKLの活性を阻害し、この過程は解糖系の調節機構の一部をなしている。ステロイドホルモンシグナルにおいて、O-GlcNAcは転写の負の調節因子として作用する。またOGTは、5-メチルシトシンを5-ヒドロキシメチルシトシンへ変換し転写を調節する酵素であるTET2と直接相互作用する。
OGTによるO-GlcNAcレベルの増大は、アルツハイマー病患者に対して治療効果を有する可能性がある。アルツハイマー病患者では脳内でのグルコース代謝が損なわれており、その結果タウの高リン酸化やO-GlcNAc化の低下が引き起こされていることが研究から示唆されている。脳内でのタウのO-GlcNAc化の再活性化は、プロテインホスファターゼ処理とともにこうした病理過程を抑制し、脳内のグルコース代謝を改善すると考えられている。
出典
関連項目
- O-GlcNAc
- O-GlcNAcアーゼ
- O-結合型グリコシル化
外部リンク
- The O-GlcNAc Database - A curated database for protein O-GlcNAcylation and referencing more than 14 000 protein entries and 10 000 O-GlcNAc sites.
- Protein O-GlcNAc transferase - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)